氧化还原反应实验报告的注意事项(氧化还原反应配平技巧)
氧化还原反应方程式的配平在高中学习阶段是重点也是难点,所以学好这一部分知识十分重要。
一、配平原则
(1)电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高的总数等于化合价降低的总数。
(2)质量守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
二、配平步骤
(1)标变价:标明反应前后变价元素的化合价
(2)列得失:列出化合价的变化值
(3)求总数:通过求最小公倍数使化合价升降总值相等
(4)配系数:确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,用观察法配平其他物质的化学计量数。
(5)查守恒:检查质量与电荷、电子是否分别守恒。
三、配平技巧
(1)逆向配平法:
若氧化剂(还原剂)中某元素化合价只有部分改变,或某物质自身发生氧化还原反应(歧化反应),可用逆向配平法,即选择氧化产物、还原产物为基准来配平(当从反应物很难配平时,可选择逆向配平法)。此处我们使用P4和CuSO4的反应作为例子:

该反应的氧化剂是P4、CuSO4,还原剂是P4,以反应物作基准求得失电子数比较困难,但是氧化产物只有H3PO4、还原产物只有Cu3P,所以以H3PO4和Cu3P作基准物容易求得失电子数。
Cu3P中Cu为﹢1价,P为﹣3价,由P4、CuSO4生成Cu3P,化合价总的降低6;由P4生成H3PO4,化合价升高5,则Cu3P与H3PO4的化学计量数之比为5∶6,再根据原子守恒配平,该反应方程式为:
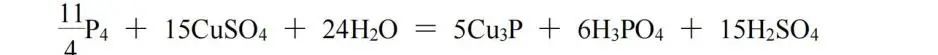
因此各物质前的系数需再乘以4,最终结果为:
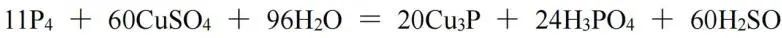
(2)当遇到一种物质中的变价元素未完全发生变价时,可以进行双向配平。此处我们使用Cu2S和HNO3的反应作为例子:
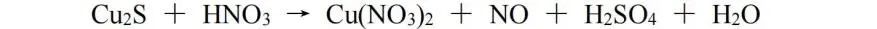
Cu2S中Cu为﹢1价,S为﹣2价,生成物中Cu为﹢2价,S为﹢6价,化合价总的升高10;由HNO3生成NO,化合价降低3。因HNO3中N元素未全部得电子,以Cu2S和HNO3为基准求得的系数不是最终的系数,此时应以Cu2S与NO为基准,则Cu2S与NO的化学计量数之比为3∶10,再根据原子守恒配平,该反应方程式为:
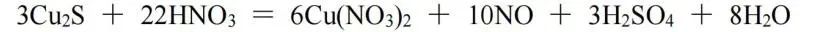
(3)巧令化合价法:
无法用常规方法确定物质中各元素的化合价时,先令其均为零价或者其他常见的化合价(总的化合价之和为微粒所带电荷数),然后根据化合价升降配平。此处我们使用Fe3C和HNO3的反应作为例子:
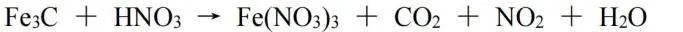
令Fe3C中Fe、C均为0价,生成物中Fe、C的化合价分别为﹢3价、﹢4价,化合价总的升高13价;若令Fe3C中Fe、C分别为﹢3价、﹣9价(实际上不可能),则化合价总的还是升高13价;由HNO3生成NO2,化合价降低1,则Fe3C与NO2的化学计量数之比为1∶13,再根据原子守恒配平,该反应方程式为:
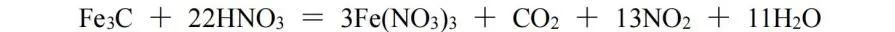
(4)整体标价法:
当某元素的原子在某化合物中有多个时,可以将它们作为一个整体对待,根据化合物中元素化合价代数和为零原则给整个整体标价。此处我们使用S和Ca(OH)2的反应作为例子:
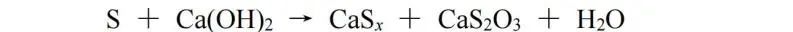
生成物CaSx、CaS2O3中的Sx、S2作为一个整体分别标价为﹣2价、﹢4价,S转化为CaSx,化合价降低2价,S转化为CaS2O3,化合价升高4价,则CaSx与CaS2O3的化学计量数之比为2∶1,再根据原子守恒配平,该反应方程式为:
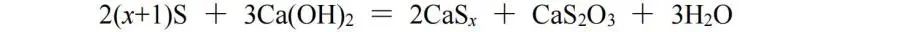
当遇到一种物质中有两种或多种元素变价时,可以进行整体配平。此处我们使用Cu2S和HNO3的反应作为例子:
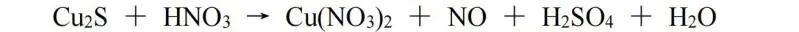
Cu2S中Cu为﹢1价,S为﹣2价,生成物中Cu为﹢2价,S为﹢6价,化合价总的升高10;由HNO3生成NO,化合价降低3,则Cu2S与NO的化学计量数之比为3∶10,再根据原子守恒配平,该反应方程式为:
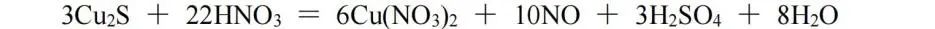
(5)离子-电子法:
该方法特别适合氧化还原离子反应方程式的配平。此处我们用Cu2O与H+、NO3(-)的反应作为例子:
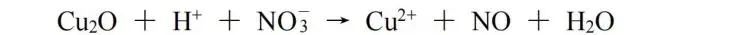
1、先将反应物和产物以离子的形式列出(难溶物、弱电解质和气体均以分子式表示)
2、将反应式分成两个半反应:一个是氧化反应,另一个是还原反应。

3、加入一定数目的电子和介质(酸性条件下用氢离子和水分子;碱性条件下用氢氧根和水分子),使得半反应两边的原子个数和电荷数相等,这是配平的关键步骤。

4、根据氧化还原反应中得失电子必须相等,将两个半反应乘以相应的系数,合并成一个配平的离子方程式。
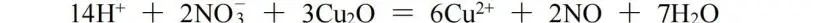
离子-电子法配平的关键是:第一,根据弱电解质的存在形式,可以判断离子反应是在酸性条件还是碱性条件中进行;第二,正确添加介质。在酸性介质中,去掉氧离子,必须添加氢离子,添加氧离子必须添加水分子;在碱性介质中,去掉氧离子必须加水分子,添加氧离子必须添加氢氧根,因为在一个离子方程式中不可能同时出现氢离子和氢氧根。
离子-电子法的优点很明显,第一,不用计算氧化剂或者是还原剂的化合价的变化;第二在配平过程中,不参与氧化还原反应的物种同时被配平;第三,两个配平的半反应恰好是原电池中的电极反应式。
(6)H、O原子加减法
对于有机化合物之间的氧化还原反应,由于很难计算反应前后有机物中一些元素的化合价的变化,所以用化合价配平不是一个合适的方法。比较好的配平方法是比较反应前后有机物中的H、O原子数的变化来入手,然后转变成化合价变化值,求得相应的最小公倍数来配平。加两个H、减一个O,化合价均降低2,反之则增加,此处我们用C3H8和O2的反应作为例子:
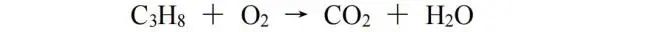
从C3H8 → 3CO2,右边比左边少8个H、多6个O,可看作化合价总的升高20价,而O2 → 2H2O,化合价降低4价,则C3H8与O2的化学计量数之比为1∶5,再根据原子守恒配平,该反应方程式为:
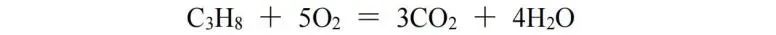
再举个例子:
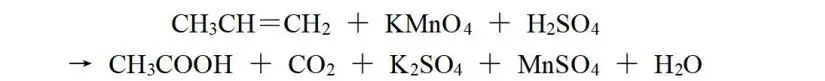
CH3CH=CH2与CH3COOH和CO2相比较,后者比前者多4个O、少2个H,可看作化合价总的升高10价;由KMnO4转化为MnSO4,化合价降低5价,则CH3CH=CH2与KMnO4的化学计量数之比为1∶2,再根据原子守恒配平,该反应方程式为:
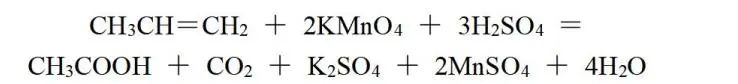
若将反应改为:
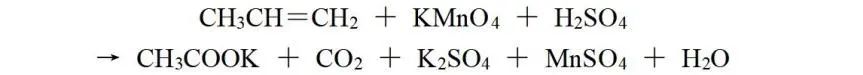
因K的化合价与H相同,可以把其看作H,CH3CH=CH2与CH3COOK和CO2相比较,化合价总的升高还是10价。则CH3CH=CH2与KMnO4的化学计量数之比仍为1∶2,再根据原子守恒配平,该反应方程式为:
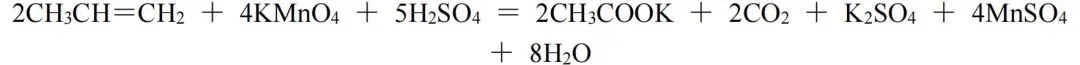
该方法不仅适用于有机化合物的反应,对于某些无机化合物的反应,也可使用该方法配平。此处我们使用S3O6( 2-)转化为HS-的半反应作为例子:
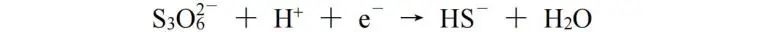
由S3O6( 2-)转化为3HS-,O原子减少6个,H原子增加3个,电荷多1个,可看作总的得16 e-,再根据原子守恒和电荷守恒配平,该反应式为:
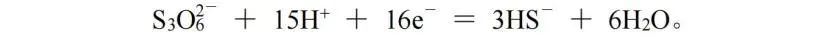
在实际应用中,多种方法的灵活搭配使用,往往能起到事半功倍的效果!
